Définition de la masse des éléments
Lorsqu’on parle de la masse d’une molécule ou d’un atome, il est nécessaire de préciser de quel type de masse il s’agit, selon le niveau de simplicité ou de précision recherché. En spectrométrie de masse, cette distinction est essentielle.
Masse nominale
La masse nominale est la forme la plus simple de masse. Elle correspond à la masse d’un atome arrondie à l’unité entière, exprimée en daltons (Da).
Par exemple :
-
la masse nominale de l’hydrogène est 1 Da ;
-
la masse nominale de l’oxygène est 16 Da.
Ainsi, la masse nominale d’une molécule d’eau (H₂O) est 18 Da.
La masse nominale est utile pour une description rapide, mais elle ne tient pas compte des isotopes naturels ni de la masse réelle des atomes, ce qui limite fortement sa précision. En spectrométrie de masse, la masse nominale est très peu utilisée, même avec des spectromètres de faible pouvoir résolutif, et elle est totalement insuffisante pour les spectromètres de masse à haut pouvoir résolutif.
Cette imprécision s’explique principalement par deux raisons.
1. Présence des isotopes naturels et masse moyenne
Les éléments chimiques existent naturellement sous forme de plusieurs isotopes. Par exemple, le carbone est principalement composé de :
-
¹²C (~99 %),
-
¹³C (~1 %).
Dans ce cas, la masse moyenne du carbone est donnée par la moyenne pondérée des isotopes naturels :
0,99×12+0,01×13=12,01
Pour les spectromètres de masse de faible pouvoir résolutif, incapables de distinguer des masses très proches, c’est souvent cette masse moyenne qui est mesurée. Ce point sera illustré plus tard dans la section consacrée aux isotopes.
2. Masse exacte des isotopes
La deuxième raison est que la masse exacte d’un isotope n’est pas un nombre entier.
Par exemple, la masse exacte de l’atome d’hydrogène n’est pas 1 Da, mais :
1,007825
Cette différence peut sembler faible, mais elle devient rapidement significative :
-
pour une petite molécule contenant 100 atomes d’hydrogène, l’écart entre masse nominale et masse exacte est déjà de 0,7825 Da ;
-
pour des molécules plus grandes, contenant des centaines de milliers d’atomes d’hydrogène, cette différence devient très importante.
Masse mesurée
La masse obtenue expérimentalement à l’aide d’un spectromètre de masse est appelée masse mesurée.
Il est important de noter que même un spectromètre de masse à ultra-haut pouvoir résolutif ne mesure pas directement la masse exacte. La masse exacte est obtenue uniquement par des calculs théoriques, ce qui explique pourquoi on parle également de masse théorique.
Masse monoisotopique
La masse monoisotopique correspond à la masse exacte de l’isotope le plus abondant d’un élément.
Par exemple, pour le carbone, l’isotope le plus abondant est ¹²C, et sa masse est exactement 12 Da.
Il est intéressant de noter que le carbone ¹²C est le seul isotope pour lequel la masse exacte est égale à la masse nominale, car il sert de référence internationale pour la définition de l’unité de masse atomique.
En résumé
-
Masse nominale :
Masse arrondie à l’unité entière (Da), simple mais très imprécise. -
Masse moyenne :
Moyenne pondérée des masses des isotopes naturels selon leur abondance. -
Masse exacte = masse théorique = masse monoisotopique le plus abondant:
Masse réelle calculée d’un isotope donné. -
Masse mesurée :
Masse obtenue expérimentalement par le spectromètre de masse.
Les isotopes
Les isotopes en spectrométrie de masse sont particulièrement utiles, notamment pour la quantification, mais aussi pour l’identification des éléments à partir de leur profil isotopique. De plus, l’analyse de la distribution isotopique permet de déterminer facilement l’état de charge d’un ion. Le calcul de l’état de charge repose sur une relation simple : l’état de charge correspond à l’inverse de l’écart en m/z entre deux pics isotopiques adjacents. La relation s’écrit ainsi :
état de charge (z)=1/Δm/z, où Δm/z représente la différence de masse entre deux pics isotopiques adjacents.
En pratique, ce calcul est généralement effectué automatiquement par les logiciels de traitement des données, qui déterminent l’état de charge et l’affichent directement sur le spectre de masse, comme illustré dans la figure 1.
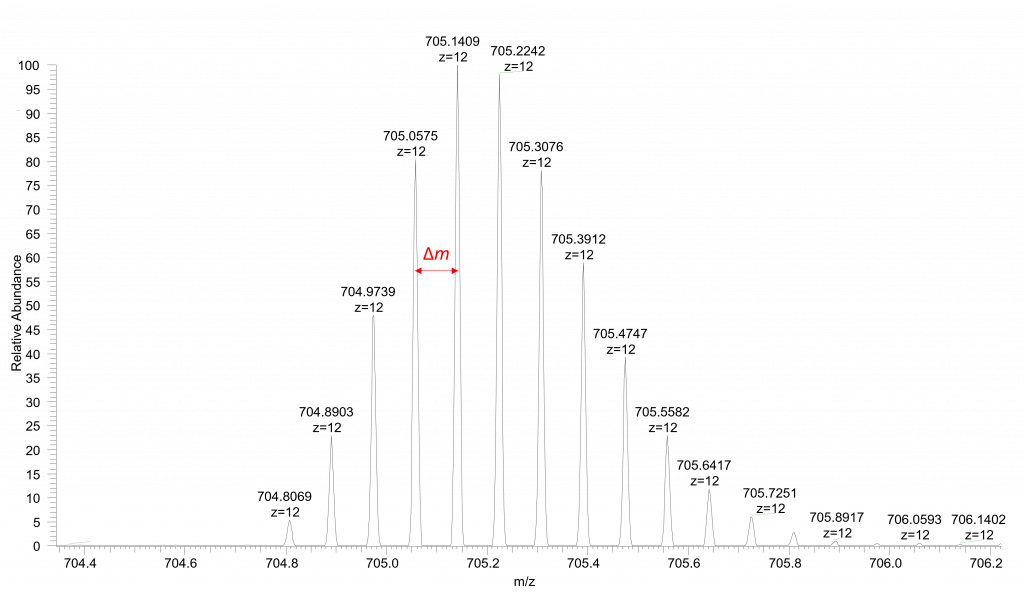
Cependant, les isotopes présentent également des inconvénients qui compliquent l’interprétation des spectres de masse, en particulier pour les molécules de grande taille. La combinaison de plusieurs isotopes au sein d’une même molécule entraîne une superposition de nombreux pics isotopiques, rendant l’analyse du spectre plus complexe. À l’état naturel, même si la proportion des isotopes lourds est relativement faible (tableau 1), une molécule contenant un grand nombre d’atomes — par exemple une longue chaîne carbonée — voit fortement augmenter la probabilité de contenir un ou plusieurs atomes de ¹³C. Cette accumulation d’isotopes lourds élargit l’enveloppe isotopique et complique davantage l’identification et l’interprétation des ions observés dans le spectre de masse.
| Atomes | Symbol | Masse | Abondance |
| Hydrogen | H(1) | 1.007825 | 99.99 |
| Hydrogen | H(2) | 2.014102 | 0.015 |
| Carbon | C(12) | 12.000000 | 98.90 |
| Carbon | C(13) | 13.003355 | 1.10 |
| Oxygen | O(16) | 15.994915 | 99.76 |
| Oxygen | O(17) | 16.999131 | 0.038 |
| Oxygen | O(18) | 17.999159 | 0.20 |
| Nitrogen | N(14) | 14.003074 | 99.63 |
| Nitrogen | N(15) | 15.000109 | 0.37 |
Tableau 1 : Isotopes des atomes les plus fréquemment rencontrés en biologie.
Considérons d’abord un cas très simple : une population d’ions identiques, par exemple 100 000 ions, dont la formule chimique ne contient qu’un seul atome de carbone. Le carbone naturel est composé d’environ 99 % 12C et 1% de 13C. Dans cette population, on aura donc environ 99 000 ions contenant 12C et 1 000 ions contenant 13C. Sur le spectre de masse, on observera alors deux pics :
- un pic principal d’intensité 99 correspondant à 12C
- un pic secondaire d’intensité 1 correspondant à 13C
Cependant, ce cas idéal est rarement rencontré en pratique. En réalité, les ions contiennent souvent plusieurs atomes de carbone, ce qui complique fortement le spectre isotopique.
Prenons l’exemple d’un ion contenant 20 atomes de carbone.
Le premier pic (pic monoisotopique) correspond aux ions ne contenant que du 12C. Sa probabilité est donnée par , soit environ 81 %. Les 19 % restants correspondent aux ions contenant au moins un atome de 13C.
Il est important d’insister sur l’expression « au moins un », car cette population ne génère pas un seul pic, mais plusieurs pics isotopiques :
- Un deuxième pic correspond aux ions contenant exactement un atome de 13C (pic M+1),
- Un troisième pic correspond aux ions contenant exactement deux atomes de 13C (pic M+2),
- et ainsi de suite, avec des intensités décroissantes.
Ainsi, le spectre de masse présente une enveloppe isotopique, résultant de la distribution statistique des isotopes du carbone dans la molécule (voir image 2)

Pour les grosses molécules telles que les protéines, la situation devient encore plus complexe, car il est nécessaire de tenir compte non seulement des isotopes du carbone, mais également de ceux des autres éléments constitutifs, notamment l’hydrogène et l’azote. Prenons l’exemple d’une petite protéine, le cytochrome c. Sa masse moyenne est de 11703,41837 Da, tandis que sa masse monoisotopique est de 11696,0612 Da, correspondant à la formule chimique C₅₂₂H₈₃₄N₁₄₄O₁₅₁S₅. Si l’on considère uniquement les isotopes du carbone, le premier pic isotopique devrait représenter environ 0,526 % de l’intensité totale. En revanche, lorsque l’on prend en compte l’ensemble des isotopes naturels des autres éléments, en particulier ceux de l’azote et de l’hydrogène, l’intensité réelle de ce premier pic isotopique diminue et n’atteint plus que 0,28 %, comme illustré dans la figure 3.
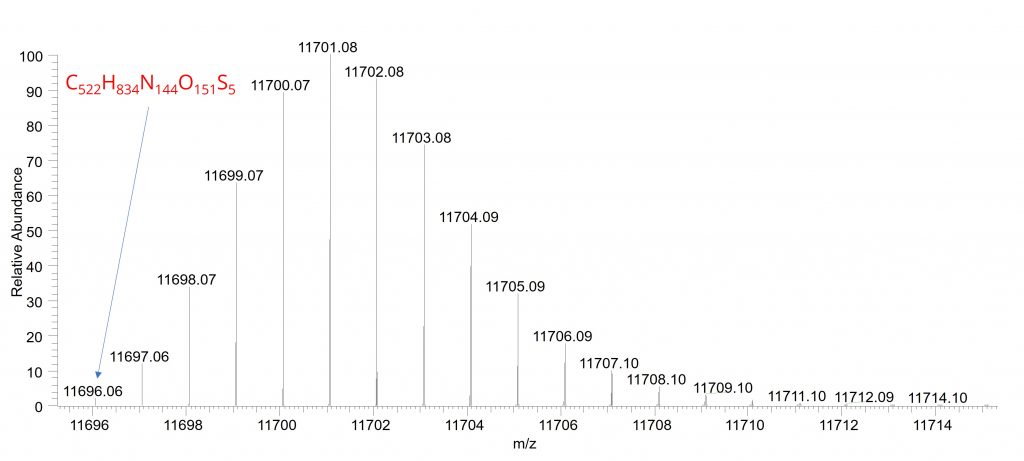
Au-delà de la complexification de l’interprétation des spectres de masse, la présence des isotopes complique également le choix de l’ion précurseur à fragmenter. En effet, si l’on sélectionne le pic monoisotopique, celui-ci présente souvent une intensité très faible pour les grosses molécules, ce qui peut conduire à un nombre limité de fragments détectables après fragmentation.
À l’inverse, si l’on choisit de fragmenter le pic isotopique le plus intense, les ions produits contiennent une proportion plus élevée de ¹³C (ou autres isotopes lourds provenant de l’azote, de l’oxygène ou du soufre). Cette incorporation isotopique entraîne un décalage des masses des fragments et peut compliquer, voire nuire, à leur identification correcte lors de l’analyse des spectres de fragmentation.
Ce compromis entre intensité du précurseur et pureté isotopique constitue ainsi un défi majeur dans les expériences de spectrométrie de masse des protéines.
