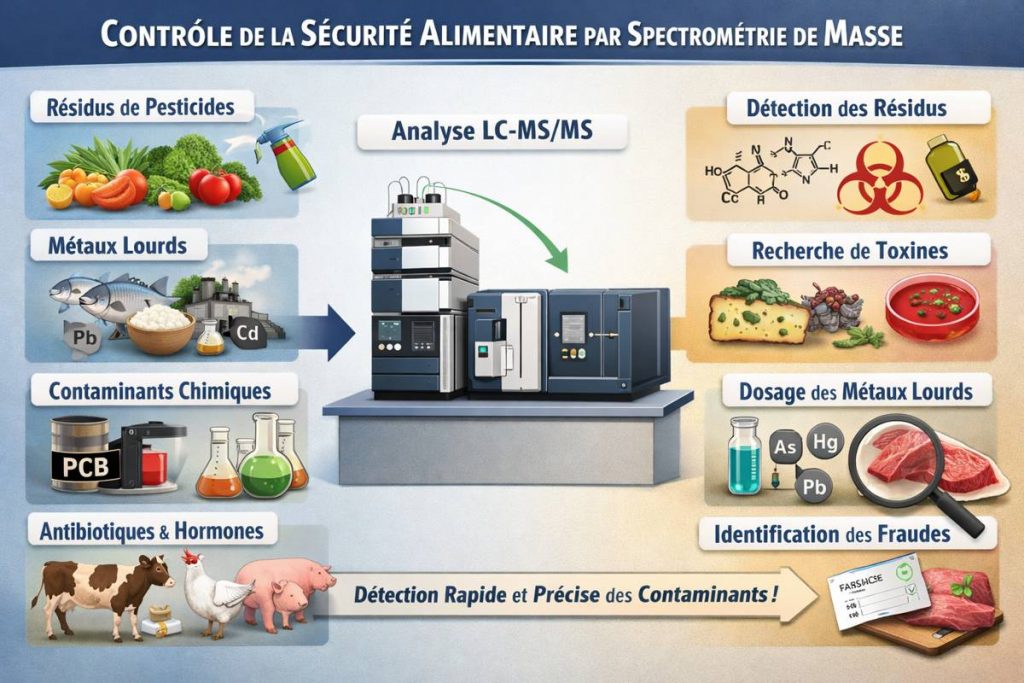
Application de la spectrométrie de masse à la sécurité alimentaire
La sécurité alimentaire constitue aujourd’hui un enjeu majeur de santé publique à l’échelle mondiale, particulièrement dans les pays en développement. La mondialisation du commerce agroalimentaire a profondément modifié les modes de production, de transformation et de distribution des denrées alimentaires. Dans ce contexte, des substances chimiques et biologiques interdites ou strictement réglementées sont parfois introduites illégalement dans la chaîne de production alimentaire, ce qui représente une menace croissante pour la santé des consommateurs.
Parmi les principaux risques figurent les maladies d’origine alimentaire liées aux agents pathogènes microbiens, aux biotoxines et aux contaminants chimiques. L’utilisation de pesticides lors de la production et du stockage des denrées peut entraîner la présence de résidus toxiques dans les aliments. De même, les métaux lourds peuvent contaminer les produits alimentaires via le sol, l’eau ou les matériaux d’emballage, tandis que divers polluants environnementaux, tels que les biphényles polychlorés (PCB), peuvent s’y accumuler. Ces substances sont susceptibles de provoquer des effets toxiques graves, allant de troubles chroniques à des maladies cancéreuses.
L’emploi d’antibiotiques et de promoteurs de croissance dans l’élevage constitue également un problème majeur, en raison du risque de résidus dans les produits d’origine animale et de l’émergence de résistances bactériennes. Face à l’ampleur de ces menaces, il est indispensable de disposer de méthodes analytiques capables d’identifier et de quantifier avec précision les agents chimiques et biologiques responsables de la contamination des aliments.
Dans ce contexte, la chromatographie liquide couplée à la spectrométrie de masse (LC-MS) s’impose comme un outil analytique incontournable. Grâce à sa grande sensibilité, sa rapidité d’analyse et sa capacité à détecter une vaste gamme de composés — allant des molécules inorganiques et organiques aux biomolécules, la LC-MS est aujourd’hui l’une des techniques de référence pour la surveillance de la sécurité alimentaire et la lutte contre les pratiques frauduleuses et illégales.
| Tableau des contaminants dangereux dans les aliments | |
| Agents contaminants des aliments | Exemples |
| Pesticides (>800 composés)
|
Herbicides (carbaryl, diuron, linuron)
Insecticides (malathion, parathion) Fongicides (imazalil, carbendazime) |
| Antibiotiques
|
Aminosides (kanamycine, néomycine)
ß-lactamines (amoxicilline, chloxacillin) Macrolides (tylosine, tilmicosine, spiramycine) Nitrofuranes (ronidazole) Quinolones (ofloxacine, norfloxacine, la ciprofloxacine) Sulfamides (Sulfacétamide, sulfaquinoxaline) Tétracyclines (tétracycline, chlortétracycline) Amphénicols (Chloramphénicol) |
| Promoteurs de croissance
|
Stilbènes (Dienestrol, diéthylstilbestrol)
Agents antithyroïdiens (Mercaptobenzimidazol, méthylthiouracile) Androgènes stéroïdiens (éthylestrénol, methandriol) Lactones d’acide résorcyliques (α-zéranol) ß-agonistes (clenbuterol, terbutaline) |
| Mycotoxines | Aflatoxines, ochratoxine A, patuline, trichothécènes, fumonisines |
| Phycotoxines | L’acide domoïque, l’acide okadaïque, saxitoxine, microcystines, azaspiracides, pectenotoxines, yessotoxines
Alcaloïdes de l’ergot de seigle (ergométrine, ergotamine, ergosine, ergocristine, ergocryptine et ergocornine) |
| Contaminants environments | Sulfonate de perfluorooctane (SPFO)
L’acide perfluorooctanoïque (PFOA) Les parents Compose, y compris les diastéréoisomères et les énantiomères Nanotubes en carbone Fullerènes Acrylamide L’histamine, la putrescine 2-amino-1,6-diméthylimidazo [4,5-b] pyridine 2-aminodipyrido [1,2-a: 2′-d 3 ‘] -imidazole Semicarbazide Ethylcarbamates La mélamine, l’amméline, l’ammélide et l’acide cyanurique Dibutyl phtalate (DBP) Benzyl butyl phtalate (BBP) di-2-éthylhexyle (DEHP), di-isononyl phtalate ‘(DINP) di-phtalate’isodecyl ‘(DIDP) Thioxanthone 2-isopropylique (ITX) 2-ethylhexyl-4-diméthylaminobenzoate (EHDAB |
| Métaux lourds | Plomb, Arsenic, Mercure… |
Tableau 1 — Classification des agents chimiques et biologiques contaminant les denrées alimentaires et leurs risques sanitaires
Analyse des pesticides par LC-MS
Les résidus de pesticides constituent l’un des principaux enjeux de la sécurité alimentaire. Leur analyse est particulièrement complexe en raison du grand nombre de substances autorisées à des limites maximales de résidus (LMR) très variables, ainsi que de composés strictement interdits pouvant néanmoins être détectés dans les denrées alimentaires. Dans ce contexte, la chromatographie liquide couplée à la spectrométrie de masse (LC-MS) est devenue la technique de référence pour l’analyse des résidus de pesticides, avec une croissance exponentielle de son utilisation au cours des dernières décennies.
La LC-MS est parfaitement compatible avec des méthodes de préparation d’échantillons simples, rapides et robustes, telles que la méthode QuEChERS (Quick, Easy, Cheap, Efficient, Rugged and Safe), ce qui élargit considérablement son champ d’application. Elle permet de réaliser aussi bien des analyses ciblées que non ciblées, et de détecter simultanément un grand nombre de substances en un temps très court.
L’analyse ciblée repose sur le développement de méthodes spécifiques pour des composés prédéfinis, sélectionnés en fonction de leur toxicité, de leur fréquence de détection ou des exigences réglementaires. La tendance actuelle est au développement de méthodes multirésidus à grande échelle, capables de surveiller plusieurs centaines de pesticides en une seule analyse. Ces méthodes sont principalement mises en œuvre par LC-MS/MS à l’aide de spectromètres de masse de type triple quadripôle (QqQ), quadripôle piège à ions linéaire (QqLIT) et temps de vol (TOF-MS).
Les spectromètres triple quadripôle sont aujourd’hui la technologie de référence pour la quantification des pesticides par surveillance de réactions multiples (SRM/MRM). Les instruments modernes, grâce à leurs vitesses de balayage élevées et à leur excellente sensibilité, permettent de quantifier simultanément 100 à 150 composés, voire davantage, tout en conservant un bon rapport signal/bruit, même avec des chromatographies rapides. Le couplage avec l’Ultra Performance Liquid Chromatography (UPLC), utilisant des colonnes C18 à particules inférieures à 2 µm, réduit considérablement les temps d’analyse et améliore la sensibilité et la résolution, ce qui est particulièrement adapté au contrôle de routine en sécurité alimentaire.
Les instruments hybrides QqLIT combinent les capacités quantitatives du triple quadripôle (modes SRM et perte neutre) avec celles d’un piège à ions linéaire offrant une grande capacité d’accumulation d’ions. Ils permettent non seulement la quantification, mais aussi la confirmation structurale des pesticides grâce aux modes ions produits améliorés, fragmentation retardée et MS³. Jusqu’à 200 composés peuvent ainsi être analysés dans une seule analyse LC-MS/MS avec deux transitions SRM [1] par analyte. Ces modes sont particulièrement utiles pour confirmer des pesticides présents à très faible concentration ou présentant des rapports de transitions défavorables, comme la spinosyne A. Des stratégies de type data-dependent acquisition permettent également de combiner les modes SRM et MS/MS pour renforcer l’identification.
Les spectromètres à analyseur temps de vol (TOF-MS) fonctionnent en mode balayage complet et offrent la possibilité de détecter un nombre théoriquement illimité de composés. La masse exacte mesurée constitue une signature quasi universelle pour chaque analyte, ce qui permet le développement de bases de données comparables à celles utilisées en GC-MS. Dans ce cadre, l’UPLC-TOF-MS est une technique puissante pour le dépistage à large spectre et l’analyse de masse exacte en routine [2]. Elle présente également une excellente sensibilité en mode full scan, permettant de détecter les pesticides à des concentrations compatibles avec les exigences réglementaires. De nombreuses études ont démontré que la LC-TOF-MS offre des performances satisfaisantes pour la quantification [3,4].
Les instruments hybrides combinant des analyseurs quadripolaires ou piège à ions avec un Orbitrap [5,6] représentent l’évolution la plus récente pour l’analyse des pesticides. Ils associent une très haute résolution, une excellente sensibilité et une précision de masse inférieure au ppm, tout en permettant l’acquisition rapide de spectres MS/MS, ce qui les rend particulièrement adaptés aux analyses multirésidus complexes.
L’analyse non ciblée vise à détecter tous les composés présents dans l’échantillon, qu’ils soient ou non des pesticides connus. Elle permet d’identifier des pesticides inattendus, des produits de dégradation, des impuretés ou d’autres composés potentiellement toxiques. Cette approche est plus complexe car elle nécessite l’identification de composés inconnus. Le potentiel de la LC-TOF-MS pour ce type d’analyse a été démontré par l’identification de l’imazalil et des produits de dégradation du prochloraz [7], en combinant la masse exacte et les données de fragmentation obtenues par MSⁿ dans des pièges à ions. Les instruments QqTOF sont particulièrement adaptés à cette approche grâce à leur précision de masse, leur sensibilité en full scan et leurs capacités MS/MS. Néanmoins, l’analyseur Orbitrap [8] est aujourd’hui considéré comme l’outil le plus performant pour l’analyse non ciblée, grâce à sa très haute résolution et sa précision de masse (<1 ppm), qui permettent de proposer des formules élémentaires et de confirmer les structures par MSⁿ au cours d’une même analyse.
La LC-MS/MS pour l’analyse des mycotoxines
Les mycotoxines et les biotoxines algales constituent deux grandes classes de toxines naturelles majeures en sécurité alimentaire, caractérisées par une toxicité élevée et des effets sanitaires graves même à très faibles concentrations. Avant l’essor des spectromètres de masse modernes et des sources d’ionisation à pression atmosphérique telles que l’électrospray (ESI), l’analyse des mycotoxines [9] reposait sur des méthodes spécifiques à chaque classe de composés. Les techniques classiques comprenaient la chromatographie liquide avec détection UV ou fluorescence, la chromatographie en phase gazeuse avec détecteur à ionisation de flamme, la détection électrochimique, ainsi que les tests immuno-enzymatiques (ELISA). La spectrométrie de masse était également utilisée, mais principalement pour des analyses ciblées de mycotoxines [10] individuelles ou de groupes restreints.
L’introduction de spectromètres de masse en tandem (MS/MS) rapides et très sensibles, associés à des sources d’ionisation à pression atmosphérique (ESI, APCI), a profondément transformé l’analyse des mycotoxines [11]. Il est désormais possible d’effectuer des analyses multirésidus sur des échantillons de routine après une extraction non spécifique. La LC-MS/MS s’est ainsi imposée comme une technique extrêmement spécifique, rapide, précise et sensible, offrant un meilleur rendement analytique que les méthodes traditionnelles. Sa sensibilité élevée permet de réduire les étapes de préparation d’échantillons tout en autorisant l’analyse simultanée de plusieurs contaminants.
Dans le cas particulier des mycotoxines, la LC-MS/MS constitue un outil de référence permettant de confirmer à la fois la présence et la structure de nombreuses toxines en une seule analyse, avec une excellente fiabilité et dans des délais réduits. Cette approche est particulièrement adaptée à la surveillance réglementaire, où plusieurs dizaines de mycotoxines peuvent coexister dans un même échantillon.
Le MALDI-TOF/MS est également largement utilisé pour le dépistage rapide des mycotoxines, notamment grâce à sa capacité d’analyse à haut débit. Catharino et al[12]. ont montré que le MALDI-TOF/MS permettait de détecter les mycotoxines avec des limites de détection de l’ordre de 50 fmol, soit quelques dizaines de picogrammes. Dans leur étude, des échantillons d’arachides contaminés par des champignons producteurs d’aflatoxines étaient extraits à l’aide de méthanol, KCl, CuSO₄ et eau, suivis d’une double extraction au chloroforme. Les différentes aflatoxines ont été détectées avec des intensités comparables, démontrant la robustesse de la méthode.
Le MALDI-TOF-MS et l’ESI-Q-TOF-MS/MS sont aujourd’hui des outils complémentaires pour le criblage rapide [13,14,15], la quantification des toxines connues et la caractérisation structurale des composés inconnus. Plus généralement, la spectrométrie de masse est devenue la technologie dominante pour l’analyse des mycotoxines dans les aliments. Elle permet aux laboratoires de recherche et de contrôle officiel de détecter, quantifier et identifier simultanément de multiples mycotoxines à l’aide d’un seul système analytique, avec un niveau de fiabilité compatible avec les exigences de la sécurité alimentaire moderne.
Analyse des produits pharmaceutiques vétérinaires
L’utilisation d’antibiotiques dans les systèmes de production animale intensive est devenue une pratique courante, à la fois pour le traitement des animaux infectés et à des fins préventives. Toutefois, l’usage inapproprié de ces substances, notamment comme promoteurs de croissance, a engendré de graves problèmes pour la santé publique et l’environnement, en particulier l’émergence de résistances bactériennes et la présence de résidus dans les denrées alimentaires. Il est donc indispensable de disposer de méthodes analytiques fiables pour détecter les médicaments vétérinaires dans les produits d’origine animale afin de contrôler ces pratiques illégales, garantir la sécurité alimentaire et restaurer la confiance des consommateurs.
Les principales matrices analysées pour la recherche de résidus d’antibiotiques sont les muscles, le foie, les reins, le lait, le miel et les produits de la pêche (Tableau 2). L’introduction de la chromatographie liquide couplée à la spectrométrie de masse triple quadripôle (LC-QqQ-MS) a marqué une avancée majeure dans ce domaine. Cette technologie permet la détection simultanée de nombreux composés dans des matrices biologiques complexes avec une très grande spécificité, une excellente sensibilité et une robustesse compatible avec les exigences réglementaires. La LC est préférée à la chromatographie en phase gazeuse (GC) pour l’analyse des médicaments vétérinaires, car la majorité de ces composés sont polaires, thermolabiles et peu volatils.
Aujourd’hui, les spectromètres de masse à temps de vol (TOF) et à haute résolution (HR-MS), tels que l’Orbitrap, sont de plus en plus accessibles dans les laboratoires de contrôle. Le couplage de l’ultra-haute performance en chromatographie liquide (UHPLC) avec des analyseurs TOF ou HR-MS constitue l’un des outils les plus puissants pour le dépistage multirésidus, offrant une sélectivité, une sensibilité et une vitesse d’analyse supérieures. Pour la quantification et la confirmation réglementaire, la LC-QqQ-MS demeure la technique de référence. Toutefois, ses limitations en termes de vitesse d’acquisition, de résolution de masse et de richesse d’information structurale peuvent être compensées par les systèmes UHPLC-HRMS, tels que les Orbitraps de dernière génération, qui combinent haute résolution, masse exacte et acquisition MS/MS rapide.
Lorsqu’un grand nombre de composés appartenant à différentes classes chimiques est analysé simultanément, la préparation des échantillons doit être aussi générique que possible afin d’éviter les pertes d’analytes. En spectrométrie de masse, cette contrainte augmente le risque d’effets de matrice, tels que la suppression ou l’amplification du signal, dus aux co-extraits issus de l’échantillon ou aux réactifs utilisés lors de la préparation [16,17]. Ces interférences peuvent co-éluer avec les composés cibles et modifier la formation et l’évaporation des gouttelettes dans la source ESI, perturbant [18] ainsi le processus d’ionisation et entraînant une diminution ou une augmentation artificielle du signal mesuré.
Le tableau présenté ci-dessous résume les principales méthodes multirésidus et multiclasses récemment décrites dans la littérature pour la détermination des antibiotiques et autres médicaments vétérinaires dans les aliments pour animaux et les produits d’origine animale.
| Tableau des produits antibiotiques détectés par le couplage chromatographie et spectrométrie de masse | ||
| Produits pharmaceutiques | Matrice | Technologie |
| 4 Tetracyclines; 4 Quinolones; 4 Macrolides; 3 β-lactams; 4 Sulphonamides
|
Muscle[19]
|
LC-QqQ(MS/MS)
|
| 4 Tetracyclines; 5 Quinolones; 1 Macrolide; 1 Lincosamid; 1 Aminoglycoside; 1 Sulphonamide; 1 Amphenicol
|
Miel[20]
|
LC-QqQ(MS/MS)
UHPLC-Orbitrap
|
| 3 Tetracyclines;11 Quinolones; 10 Macrolides ; 6 β-lactams; 6 Aminoglycosides ; 15 Sulphonamides; 3 Amphenicols
|
Lait[21]
|
UHPLC-ToF-MS
|
| 6 Tetracyclines; 14 Quinolones; 9 Macrolides ; 12 β-lactams; 23 Sulphonamides
|
Muscle, rein, Foie[22]
|
UHPLC-ToF-MS
|
| 4 Tetracyclines; 9 Quinolones; 4 Macrolides ; 7 β-lactams; 14 Sulphonamides
|
Muscle[23]
|
UHPLC-QqQ(MS/MS)
|
| 1 Tetracycline; 3 Quinolones; 4 Macrolides; 2 Sulphonamides
|
Lait[24]
|
UHPLC-QqQ(MS/MS)
|
| 6 Tetracyclines; 14 Quinolones; 10 Macrolides; 23 β-lactams; 24 Sulphonamides
|
Lait[25]
|
UHPLC-ToF-MS
|
| 3 Tetracyclines; 10 Quinolones; 10 Macrolides; 15 β-lactams; 8 Aminoglycosides ; 9 Sulphonamides
|
Lait[26]
|
UHPLC-QqQ(MS/MS)
|
| 7 Tetracyclines; 14 Quinolones; 10 Macrolides; 12 Sulphonamides
|
Lait[27] | UHPLC-QqQ(MS/MS) |
| 12 Quinolones; 16 Sulphonamides
|
Muscle[28]
|
LC-QqQ(MS/MS) |
| 4 Tetracyclines; 10 Macrolides; 7 β-lactams; 11 Quinolones; 15 Sulphonamides; 2 Amphenicols
|
Poisson, œufs, muscle[29]
|
UHPLC-ToF-MS
|
| 3 Tetracyclines; 4 Quinolones; 9 Macrolides; 4 β-lactams; 6 Aminoglycosides ; 8 Sulphonamides ; 2 Amphenicols
|
Muscle[30]
|
LC-QqQ(MS/MS)
|
| 8 β-lactams; 11 Quinolones
|
Lait[31]
|
LC-QqQ(MS/MS)
UHPLC-QqQ(MS/MS) |
| 4 Tetracyclines; 5 Macrolides; 7 Penicillins; 8 Quinolones; 12 Sulphonamides
|
Œufs[32]
|
LC-QqQ(MS/MS) |
| 4 Tetracyclines; 6 Quinolones; 2 Macrolides; 5 β-lactams; 6 Sulphonamides
|
Poisson[33]
|
UHPLC-QqQ(MS/MS) |
| 2 Quinolones; 3 Macrolides; 6 Sulphonamides; Benzathine (biomarker of penicillin) | Muscle[34], poisson[35] | UHPLC-QqQ(MS/MS) |
Tableau 2 : Des produits pharmaceutiques détectés par le couplage chromatographie et spectrométrie de masse.
Détection des métaux lourds et des contaminants environnementaux
1. Métaux lourds et ICP-MS
La détection des contaminants inorganiques, tels que les métaux lourds, constitue un enjeu majeur en sécurité alimentaire. La spectrométrie de masse dispose de sources d’ionisation spécifiquement adaptées à ce type d’analyses, parmi lesquelles la source plasma à couplage inductif (ICP) est la plus utilisée. L’ICP fonctionne à des températures extrêmement élevées (5 000 à 10 000 K), capables de désintégrer les molécules en atomes libres, lesquels sont ensuite efficacement ionisés, majoritairement sous forme d’ions monochargés. Cette ionisation quasi complète confère à l’ICP-MS une sensibilité exceptionnelle et une large gamme dynamique pour l’analyse élémentaire.
Le couplage de la chromatographie liquide (HPLC) à l’ICP-MS permet non seulement de mesurer l’arsenic total, mais aussi de réaliser sa spéciation, ce qui est essentiel en toxicologie alimentaire. Plusieurs études ont ainsi identifié et quantifié l’arsénite, l’arséniate, le diméthylarsenic (DMA) et, à l’état de traces, le monométhylarsenic (MMA) [36,37] dans le riz. Les systèmes HPLC-ICP-MS permettent des analyses rapides et comparatives de l’arsenic total et de ses espèces chimiques dans différents cultivars et régions de culture. Il a notamment été montré que la proportion d’arsenic inorganique et organique varie selon l’origine géographique et le génotype : le riz cultivé aux États-Unis contient proportionnellement plus de DMA, tandis que le riz asiatique présente davantage d’arsenic inorganique [38,39]. Les études de localisation ont également révélé que l’arsenic est principalement concentré dans le son de riz.
Des applications similaires de l’ICP-MS [40] ont été réalisées pour la surveillance des métaux lourds dans les produits de la mer. Des études menées en Italie sur plus de 300 échantillons de mollusques et de poissons ont montré que le plomb, le cadmium et le mercure dépassaient fréquemment les limites réglementaires. Les mollusques bivalves et céphalopodes présentent une forte capacité d’accumulation du plomb et du cadmium, tandis que des teneurs élevées en mercure ont été observées chez certains poissons, notamment l’espadon. Ces résultats soulignent la nécessité d’un contrôle régulier des produits de la mer. De nombreuses autres études menées sur les fruits[41], légumes et épices [41] confirment également des niveaux préoccupants de contamination par le plomb, le cadmium et l’arsenic.
2. Contaminants environnementaux et de transformation
Au cours des dernières décennies, les contaminants issus de l’environnement ont fait l’objet d’une attention croissante en raison de leur toxicité et de leur bioaccumulation. Des centaines de composés ont été identifiés, parmi lesquels plusieurs sont classés comme prioritaires par les agences américaines et européennes. Les substances per- et polyfluoroalkylées (PFAS), l’hexabromocyclododécane (HBCD) et certains nanomatériaux figurent parmi les contaminants émergents les plus préoccupants. Les PFAS sont aujourd’hui majoritairement analysés par LC-MS/MS à l’aide de spectromètres QqQ ou QqLIT [44,45].
Les procédés de transformation des aliments peuvent également générer des contaminants, tels que les amines hétérocycliques, l’acrylamide et le carbamate d’éthyle. Les deux premiers sont formés lors de la cuisson à haute température, tandis que le carbamate d’éthyle résulte de processus de fermentation. La LC-MS/MS est largement utilisée pour la quantification des amines hétérocycliques [46,47], et des méthodes UPLC-ESI-MS/MS rapides ont démontré une amélioration significative de la sensibilité et une réduction du temps d’analyse. L’acrylamide est couramment mesuré par LC-MS/MS à l’aide de spectromètres QqQ [48], tandis que le carbamate d’éthyle est le plus souvent analysé par GC-MS dans les boissons alcoolisées.
3. Matériaux au contact des aliments
Les matériaux destinés à entrer en contact avec les aliments emballages, ustensiles, machines de transformation et contenants constituent une source potentielle de contamination. Les plastiques et revêtements de boîtes contiennent souvent des additifs tels que des plastifiants, des antioxydants, des encres ou des vernis susceptibles de migrer dans les aliments. Un exemple emblématique est le 2-isopropylthioxanthone (ITX), un initiateur de polymérisation UV détecté en 2005 dans du lait pour nourrissons en Italie, puis dans de nombreux produits en Europe. L’ITX est traditionnellement analysé par GC-MS, mais des méthodes LC-MS utilisant des colonnes en phase inverse (C8 ou C18) sont désormais largement répandues.
D’autres substances migrantes, telles que le bisphénol A, les phtalates et les amines aromatiques primaires, sont également surveillées par LC-MS/MS [49]. Les esters de l’acide phtalique (DBP, BBP, DEHP, DIDP) ont par exemple été détectés dans le lait et les produits laitiers[50]. Le bisphénol A, le BADGE et leurs produits d’hydrolyse font désormais l’objet de réglementations strictes concernant leur migration à partir des matériaux d’emballage.
Enfin, la mélamine constitue un contaminant majeur, pouvant provenir de l’environnement, de la migration à partir de plastiques ou être ajoutée frauduleusement pour augmenter artificiellement la teneur apparente en protéines. Après le scandale du lait infantile en Chine en 2008, de nombreuses méthodes LC-MS/MS ont été développées pour détecter la mélamine et ses métabolites (amméline, ammélide et acide cyanurique) dans les laits infantiles, la viande, les aliments pour animaux et les produits transformés.
Conclusion
La chromatographie liquide couplée à la spectrométrie de masse (LC-MS) est aujourd’hui devenue un pilier incontournable de la sécurité alimentaire moderne. Les progrès technologiques récents ont considérablement amélioré ses performances en termes de sensibilité, de sélectivité, de rapidité et de robustesse, permettant une évaluation beaucoup plus complète et fiable des contaminants et des résidus présents dans les denrées alimentaires, même à l’état de traces.
La détection et la caractérisation de nouveaux contaminants, susceptibles d’avoir des effets néfastes sur la santé humaine, constituent désormais un enjeu central de la sécurité alimentaire. Les techniques LC-MS/MS, associées aux analyseurs de masse à haute performance offrant une masse exacte et une haute résolution (TOF, QqTOF, Orbitrap), rendent possible l’identification de composés connus et inconnus avec un niveau de confiance inégalé. L’accessibilité croissante de ces instruments permet aujourd’hui le développement de stratégies de criblage à large spectre, adaptées aux exigences des laboratoires de contrôle et de recherche.
Une tendance majeure consiste à mettre en place des méthodes analytiques génériques, capables d’extraire et de détecter simultanément le plus grand nombre possible de contaminants en un temps réduit, sans compromettre les performances analytiques. La compatibilité de la LC-MS avec des protocoles de préparation simples et rapides, tels que la méthode QuEChERS ou la dilution directe d’échantillon, contribue également à améliorer l’efficacité et le débit analytique.
Enfin, la diversité des sources d’ionisation disponibles permet d’analyser des composés organiques, biologiques et inorganiques dans des matrices liquides, solides ou gazeuses. Cette polyvalence, combinée à la puissance analytique de la spectrométrie de masse, fait de la LC-MS un outil indispensable pour le contrôle, la surveillance et la protection de la chaîne alimentaire à l’échelle mondiale.
Référence
[2] F. Hernández, J.V. Sancho, M. Ibá˜nez, S. Grimalt, TrAC – Trends Anal. Chem. 27 (2008) 862
[7] E.M. Thurman, I. Ferrer, J.A. Zweigenbaum, J.F. García-Reyes, M. Woodman, A.R. Fernández-Alba, J. Chromatogr. A 1082 (2005) 71.
[8] Comprehensive qualitative and quantitative determination of pesticides and veterinary drugs in Honey using liquid chromatography–Orbitrap high resolution mass spectrometry María Luz Gómez-Pérez a, Patricia Plaza-Bola nos Roberto Romero-González José Luis Martínez-Vidal Antonia arrido-Frenich
[9] Review on sample preparation strategies and methods used for the analysis of aflatoxins in food and feed, Elisabeth Reiter1, 2, Jrgen Zentek1, 2 and Ebrahim Razzazi1, Mol. Nutr. Food Res. 2009, 53, 508 – 524
[10] D. Herebian, S. Zuhlke, M. Lamshoft, M. Spiteller, J. Sep. Sci. 32 (2009) 939.
[11] Masked Mycotoxins: Determination of a Deoxynivalenol Glucoside in Artificially and Naturally Contaminated Wheat by Liquid Chromatography−Tandem Mass Spectrometry
Franz Berthiller, Chiara Dall’Asta , Rainer Schuhmacher ,Marc Lemmens , Gerhard Adam , and Rudolf Krska J. Agric. Food Chem., 2005, 53 (9), pp 3421–3425 DOI: 10.1021/jf047798g
[12] Catharino, R. R., De Marques, L. A., Santos, L. S., Baptista, A. S. et al., Aflatoxin screening by MALDI-TOF mass spectrometry, Anal. Chem. 2005, 77, 8155–8157.
[13] Ortelli, D.; Cognard, E.; Jan, P.; Edder, P. (2009). Comprehensive fast multiresidue screening of 150 veterinary drugs in milk by ultra-performance liquid chromatography coupled to time of flight mass spectrometry. J Chromatogr B 877, 2363 – 2374.
[14] Peters, R. J. B.; Bolck, Y. J. C.; Rutgers, P.; Stolker, A. A. M.; Nielen, M. W. F. (2009). Multi-residue screennig of veterinary drugs in eggs, fish and meat using high-resolution liquid chromatography accurate mass time-of-flight mass spectrometry. J Chromatogr A 1216, 8206 – 8216.
[15] Aguilera-Luiz, M.M.; Vidal, J.L. Martínez; Romero-González, R.; Frenich, A. G. (2008). Multi-residue determination of veterinary drugs in milk by ultra-high-pressure liquid chromatography-tandem mass spectrometry. J Chromatogr A 1205, 10 – 16.
[16] Frenich, A. G.; Aguilera-Luíz, M. M.; Vidal, J. L. M.; Gonzáles, R. R. (2010). Comparison of several extraction techniques for multiclass analysis of veterinary drugs in eggs using ultra-high pressure liquid chromatography-tandem mass spectrometry. Anal Chim Acta 661, 150 – 160.
[17] Heller, D. N.; Nochetto, C. B.; Rummel, N. G.; Thomas, M. H. (2006). Development of a multiclass method for drug residues in eggs: hydrophilic solid-phase extraction cleanup and liquid chromatography/tandem mass spectrometry analysis of tetracycline, fluoroquinolone, sulfonamide and β-lactam residues. J Agr Food Chem 54, 5267 – 5278.
[18] Dasenaki, M. E.; Thomaidis, N. S. (2010). Multi-residue determination of seventeen sulfonamides and five tetracyclines in fish tissue using a multi-stage LC–ESI–MS/MS approach based on advanced mass spectrometric techniques. Anal Chim Acta 672, 93 – 102.
[19] Granelli, K.; Branzell, C. (2007). Rapid multi-residue screening of antibiotics in muscle and kidney by liquid chromatography ionization-tandem mass spectrometry. Anal Chim Acta 586, 289 – 295.
[20] Lopez, M. I.; Pettis, J. S.; Smith. I. B.; Chu, P. -S. (2008). Multiclass determination and confirmation of antibiotic residues in honey using LC-MS/MS. J Agr Food Chem 56, 1553 – 1559.
[21] Stolker, A. A. M.; Rutgers, P.; Oosterink, E.; Lasaroms, J. J. P.; Peters, R. J. B.; Van Rhijn, J. A.; Nielen, M. W. F. (2008). Comprehensive screening and quantification of veterinary drugs in milk using UPLC-ToF-MS. Anal Bioanal Chem 391, 2309 – 2322.
[22] Kaufmann, A.; Butcher, P.; Maden, K.; Widmer, M. (2008). Quantitative multiresidue method for about 100 veterinary drugs in different meat matrices by sub 2-μm particulate high-performance liquid chromatography coupled to time of flight mass spectrometry. J Chromatogr A 1194, 66 – 79.
[23] Chico, J.; Rúbies, A.; Centrich, F.; Companyo, R.; Prat, M. D.; Granados, M. (2008). High-throughput multiclass method for antibiotic residue analysis by liquid chromatography-tandem mass spectrometry. J Chromatogr A 1213, 189 – 199.
[24] Aguilera-Luiz, M.M.; Vidal, J.L. Martínez; Romero-González, R.; Frenich, A. G. (2008). Multi-residue determination of veterinary drugs in milk by ultra-high-pressure liquid chromatography-tandem mass spectrometry. J Chromatogr A 1205, 10 – 16.
[25] Ortelli, D.; Cognard, E.; Jan, P.; Edder, P. (2009). Comprehensive fast multiresidue screening of 150 veterinary drugs in milk by ultra-performance liquid chromatography coupled to time of flight mass spectrometry. J Chromatogr B 877, 2363 – 2374.
[26] Gaugain-Juhel, M.; Delépine, B.; Gautier, S.; Fourmond, M. P.; Gaidin, V.; Hurtaud-Pessel, D.; Verdon, E.; Sanders, P. (2009). Validation of a liquid chromatography-tandem mass spectrometry screening method to monitor 58 antibiotics in milk: a qualitative approach. Food Addit Contam 26:11, 1459 – 1471.
[27] Bohm, D. A.; Stachel, C. S.; Gowik, P. (2009). Multi-method for the determination of antibiotics of different substance groups in milk and validation in accordance with Commission Decision 2002/657/EC. J Chromatogr A 1216, 8217 – 8223.
[28] Stubbings, G.; Bigwood, T. (2009). The development and validation of a multiclass liquid chromatography tandem mass spectrometry (LC-MS/MS) procedure for the 151
determination of veterinary drug residues in animal tissue using a QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe) approach. Anal Chim Acta 637, 68 – 78.
[29] Peters, R. J. B.; Bolck, Y. J. C.; Rutgers, P.; Stolker, A. A. M.; Nielen, M. W. F. (2009). Multi-residue screennig of veterinary drugs in eggs, fish and meat using high-resolution liquid chromatography accurate mass time-of-flight mass spectrometry. J Chromatogr A 1216, 8206 – 8216.
[30] Martos, P. A; Jayasundara, F.; Dolbeer, J.; Jin, W.; Spilsbury, L.; Mitchell, M.; Varilla, C.; Shurmer, B. (2010). Multiclass, multiresidue drug analysis, including aminoglycosides, in animal tissue using liquid chromatography coupled to tandem mass spectrometry. J Agr Food Chem 58, 5932 – 5944.
[31] Junza, A.; Amatya, R.; Barrón, D.; Barbosa, J. (2011). Comparative study of the LC-MS/MS and UPLC-MS/MS for the multi-residue analysis of quinolones, penicillins and cephalosporins in cow milk, and validation according to the regulation 2002/657/EC, J Chromatogr B 879, 2601 – 2610.
[32] Jiménez, V.; Rubies, A.; Centrich, F.; Companyó, R.; Guiteras, J. (2011). Development and validation of a multiclass method for the analysis of antibiotic residues in eggs by liquid chromatography-tandem mass spectrometry. J Chromatogr A 1218, 1443 – 1451.
[33] Lopes, R. P.; Reyes, R. C.; González, R. R.; Vidal, J. L. M.; Frenich, A. G. (2012). Multiresidue determination of veterinary drugs in aquaculture fish samples by ultra high performance liquid chromatography coupled to tandem mass spectrometry, J Chromatogr B 895:896, 39 – 47.
[34] Lopes, R. P.; Reyes, R. C.; González, R. R.; Frenich, A. G.; Vidal, J. L. M. (2012). Development and validation of a multiclass method for the determination of veterinary drug residues in chicken by ultra high performance liquid chromatography-tandem mass spectrometry. Talanta 89, 201 – 208.
[35] Monitoring and determination of sulfonamide antibiotics (sulfamethoxydiazine, sulfamethazine, sulfamethoxazole and sulfadiazine) in imported Pangasius catfish products in Thailand using liquid chromatography coupled with tandem mass spectrometry Worawat Jansomboon a, Suwanna Kitpati Boontanon a,⇑, Narin Boontanon b, Chongrak Polprasert c, Chau Thi Da Food Chemistry 212 (2016) 635–640
[36] Schoof RA, Yost LJ, Eickhoff J, Crecelius EA, Cragin DW, Meacher DM, Menzel DB. Food
Chem Toxicol. 1999; 37:839–846. [PubMed: 10506007]
[37] Heitkemper DT, Vela NP, Stewart KR, Westphal CS. J Anal At Spectrom. 2001; 16:299–306.
[38] Meharg AA, Williams PN, Adomako E, Lawgali YY, Deacon C, Villada A, Cambell RCJ, Sun G,
Zhu YG, Feldmann J, Raab A, Zhao F, Islam R, Hossain S, Yanai J. Environ Sci Technol. 2009;
43:1612–1617. [PubMed: 19350943]
[39] Williams PN, Price AH, Raab A, Hossain SA, Feldmann J, Meharg AA. Environ Sci Technol.
2005; 39:5531–5540. [PubMed: 16124284]
[40] Oto Miedico, Marco Iammarino, Ciro Pompa, Marina Tarallo & Antonio Eugenio Chiaravalle (2015) Assessment of lead, cadmium and mercury in seafood marketed in Puglia and Basilicata (Italy) by inductively coupled plasma mass spectrometry, Food Additives & Contaminants: Part B, 8:2, 85-92, DOI: 10.1080/19393210.2014.989281
[41] Heavy metals in vegetables sold in the local market in Jordan, Osaili TM1, Al Jamali AF2, Makhadmeh IM2, Taha M1, Jarrar SK3. Food Addit Contam Part B Surveill. 2016 Sep;9(3):223-9. doi: 10.1080/19393210.2016.1181675.
[42] Heavy metals in aromatic spices by inductively coupled plasma-mass spectrometry, Daniel Giuseppe Buaa, Giovanni Annuarioa, Ambrogina Albergamoab, Nicola Ciceroab & Giacomo Dugoab, Food Additives & Contaminants: Part B: Surveillance Volume 9, Issue 3, 2016
[43] A. Jahnke, U. Berger, J. Chromatogr. A 1216 (2009) 410.
[44] I.E. Jogsten, G. Perelló, X. Llebaria, E. Bigas, R. Martí-Cid, A. KSrrman, J.L. Domingo, Food Chem. Toxicol. 47 (2009) 1577.
[45] M. Llorca, M. Farré, Y. Picó, D. Barceló, J. Chromatogr. A 1216 (2009) 7195.
[46] E. Barceló-Barrachina, E. Moyano, M.T. Galceran, J.L. Lliberia, B. Bagó, M.A. Cortes, J. Chromatogr. A 1125 (2006) 195.
[47] M.R. Khan, R. Busquets, F.J. Santos, L. Puignou, J. Chromatogr. A 1194 (2008) 155.
[48] L. Karasek, T. Wenzl, E. Anklam, Food Chem. 114 (2009) 1555.
[49] L.K. Sorensen, Rapid Commun. Mass Spectrom. 20 (2006) 1135.
[50] S.K. Mortensen, X.T. Trier, A. Foverskov, J.H.J. Petersen, J. Chromatogr. A 1091 (2005) 40.
