Introduction
L’ionisation par électrospray (ESI) [1] est aujourd’hui l’une des techniques les plus utilisées pour analyser des substances en solution avec un spectromètre de masse. Elle permet de transformer des molécules présentes dans un liquide en ions en phase gazeuse sans les casser (ionisation douce). Grâce à cela, même de très grosses molécules, comme des protéines ou leurs complexes, peuvent être étudiées facilement. Cette technique a profondément changé les sciences biomoléculaires. Elle permet en effet de détecter et de mesurer des molécules en très faibles quantités, ce qui est essentiel en biologie, en médecine ou en chimie.
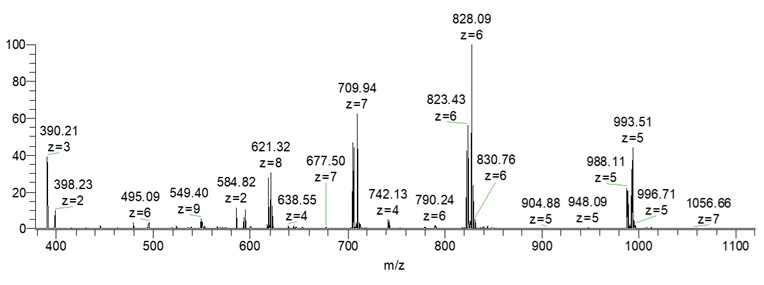
L’électrospray est devenu très populaire parce qu’il fonctionne directement avec les méthodes de séparation utilisées en laboratoire, comme la chromatographie liquide, et parce qu’il peut ioniser presque n’importe quel type de molécule. Les ions produits sont stables, ce qui améliore la qualité des résultats. Un autre avantage majeur de cette technique est la production d’ions multichargés (figure 1). Cela réduit considérablement la valeur du rapport masse/charge (m/z) observé, ce qui permet de détecter des molécules très lourdes dans une gamme de masses raisonnable. Cela améliore également la résolution, car celle-ci diminue fortement lorsque les valeurs de m/z deviennent trop élevées. Aujourd’hui, l’électrospray est indispensable pour analyser les protéines, les peptides et même des complexes non covalents fragiles qui auraient été impossibles à étudier avec des méthodes plus anciennes.
Cette source d’ionisation a été inventée en 1989 par le Professeur John Fenn [1]. En raison de son importance majeure pour le développement de la spectrométrie de masse moderne, ainsi que pour la biochimie et la biologie, il a été récompensé par le Prix Nobel de chimie en 2002.
Principe
Le principe de l’électrospray est relativement simple. L’échantillon, sous forme liquide, est poussé à travers une aiguille métallique à l’aide d’une seringue ou d’un système de chromatographie liquide (figure 2). À la sortie de l’aiguille, on applique une haute tension de quelques kilovolts. Cette tension provoque la formation de très fines gouttelettes chargées électriquement.
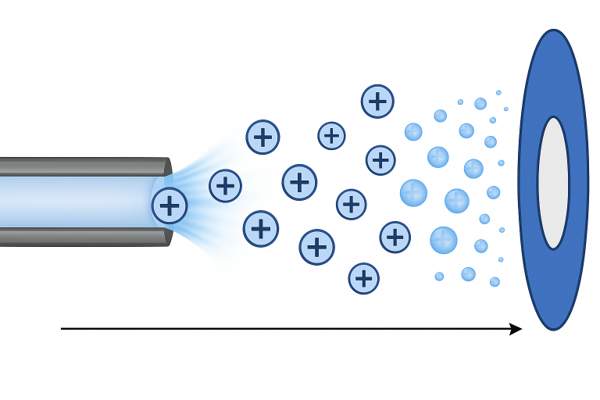
Ces gouttelettes se déplacent ensuite dans la source d’ionisation, où elles se réduisent progressivement de taille sous l’effet de la chaleur et de l’évaporation du solvant. Comme les charges se retrouvent de plus en plus proches les unes des autres, les gouttelettes finissent par exploser : c’est ce qu’on appelle l’explosion coulombienne. À force de répétition de ces étapes d’évaporation et d’explosion, les molécules finissent par être libérées sous forme d’ions isolés, prêts à entrer dans l’analyseur du spectromètre de masse. Il existe également une autre hypothèse selon laquelle les ions peuvent être expulsés directement depuis la surface des gouttelettes, sans attendre qu’elles explosent complètement. Ces deux mécanismes l’explosion coulombienne et l’émission directe d’ions ne s’excluent pas mutuellement : ils peuvent coexister et contribuer ensemble à la formation des ions observés en électrospray.
En électrospray, l’ionisation en mode positif se fait par capture d’un ou plusieurs protons (H⁺) par la molécule. À l’inverse, en mode négatif, un ou plusieurs protons sont arrachés à la molécule pour former des ions chargés négativement. Comme le proton possède une masse d’environ 1 dalton, il faut tenir compte de cette contribution lors du calcul de la masse moléculaire observée. De manière générale, le mode positif est souvent le plus sensible, mais cela dépend fortement de la structure chimique de la molécule : certaines espèces ionisent nettement mieux en mode négatif. Il est donc essentiel d’examiner la capacité de chaque molécule à accepter ou céder un proton. Par exemple, les acides, naturellement donneurs de protons, sont en général plus efficacement détectés en mode négatif.
Avantages et inconvénients de l’ionisation par électrospray (ESI)
L’ionisation par électrospray (Electrospray Ionization, ESI) présente l’avantage majeur d’être une technique d’ionisation douce, permettant la formation d’ions en phase gazeuse sans fragmentation significative des molécules analysées. Cette caractéristique est particulièrement adaptée à l’analyse de composés thermolabiles et de haute masse moléculaire, tels que les peptides, protéines, oligomères ou complexes non covalents.
Un autre avantage essentiel de l’ESI est la production d’ions multichargés, ce qui permet de ramener des espèces de masse élevée dans une gamme m/z accessible aux analyseurs de masse. Cette propriété améliore considérablement la résolution effective et la précision de mesure, notamment lorsqu’elle est couplée à des spectromètres haute résolution (Orbitrap, FT-ICR).
Enfin, l’ESI est hautement compatible avec les techniques de séparation en phase liquide (LC-MS), offrant une excellente sensibilité, une bonne reproductibilité et une large applicabilité en chimie analytique, biochimie et protéomique.
Un des principaux inconvénients de l’électrospray est sa difficulté à ioniser les molécules apolaires, qui ne possèdent pas de site capable d’accepter ou de donner un proton (comme le benzène). Dans ces situations, on doit recourir à des stratégies de dérivation chimique, consistant à greffer de manière covalente un groupe fonctionnel capable de porter une charge, afin de rendre la molécule ionisable.
Amélioration de la sensibilité en électrospray (ESI)
En pratique, afin d’améliorer la sensibilité en ionisation par électrospray, les ions sont souvent accompagnés d’un flux d’azote chauffé à haute température, favorisant la désolvatation des gouttelettes issues de la pulvérisation. Un second flux d’azote appliqué à contre-courant peut également être utilisé afin de renforcer ce processus de désolvatation.
Toutefois, pour des débits très faibles, de l’ordre de quelques centaines de nanolitres par minute, ces flux d’azote ne sont généralement pas nécessaires. En effet, les gouttelettes formées à la sortie du capillaire sont déjà de très petite taille, ce qui permet une désolvatation efficace sans assistance externe.
Avant leur entrée dans l’analyseur de masse, bien que les ions ne soient plus confinés dans des gouttelettes, ils ne sont pas encore totalement isolés et peuvent rester associés à des molécules de solvant. Ces espèces résiduelles sont en général éliminées le long du trajet vers l’analyseur par des collisions successives avec le gaz présent dans les régions intermédiaires de l’instrument. Il est ainsi possible d’ajuster les conditions de collision dans cette zone afin d’optimiser l’élimination du solvant et d’obtenir des ions plus efficacement désolvatés, améliorant ainsi la sensibilité et la qualité du signal.
L’amélioration de la sensibilité en ESI peut aussi être obtenue par l’ajout d’additifs tels que l’acide formique ou le fluorure d’ammonium, qui favorisent l’ionisation. À l’inverse, certains additifs comme le TFA (acide trifluoroacétique) peuvent diminuer fortement la sensibilité en raison de leur capacité à s’associer aux analytes ou à former des paires d’ions difficiles à vaporiser.
Bien que le mode négatif soit en général moins sensible, il est très souvent négligé par les utilisateurs. Pourtant, ce mode d’ionisation mérite une attention particulière pour certaines molécules ayant une capacité à céder un proton. De plus, en mode négatif, les fragmentations sont souvent plus propres, ce qui réduit considérablement le bruit de fond lors d’analyses ciblées. Cela peut conduire à une meilleure sélectivité et, dans certains cas, à une amélioration réelle de la sensibilité globale, malgré un signal généralement plus faible.
