Orbitrap : principe et utilisations
Historique de l’Orbitrap
L’histoire de l’Orbitrap remonte à 1923, lorsque Kingdon [1] a présenté le principe d’un dispositif permettant de piéger des ions à l’aide de champs électrostatiques. À cette époque, ce concept n’était pas destiné à la spectrométrie de masse, mais uniquement au confinement ionique.
Ce n’est que plusieurs décennies plus tard que les travaux du Dr Alexander A. Makarov et de ses collaborateurs [2,3], à partir des années 1990, ont permis une avancée décisive vers l’application de ce principe à la spectrométrie de masse. Ces travaux ont notamment porté sur :
-
la géométrie optimisée de la cellule Orbitrap,
-
et la méthode d’injection des ions, essentielle pour garantir un mouvement stable et reproductible.
Il a fallu attendre 2005 pour voir apparaître le premier spectromètre de masse Orbitrap commercialisé par la société Thermo Fisher Scientific. Depuis cette première version (Orbitrap XL, 2005), de nombreuses générations d’instruments ont été développées, offrant des résolutions nettement supérieures, des vitesses d’analyse accrues et des performances analytiques améliorées.
Principe de fonctionnement de l’Orbitrap
L’Orbitrap est un piège à ions électrostatique dans lequel les ions sont confinés et oscillent à une fréquence qui dépend uniquement de leur rapport masse/charge (m/z).
La cellule Orbitrap est constituée :
-
d’une électrode externe creuse,
-
et d’une électrode centrale coaxiale, de forme fuselée (Figure 1), portée à une haute tension électrique.
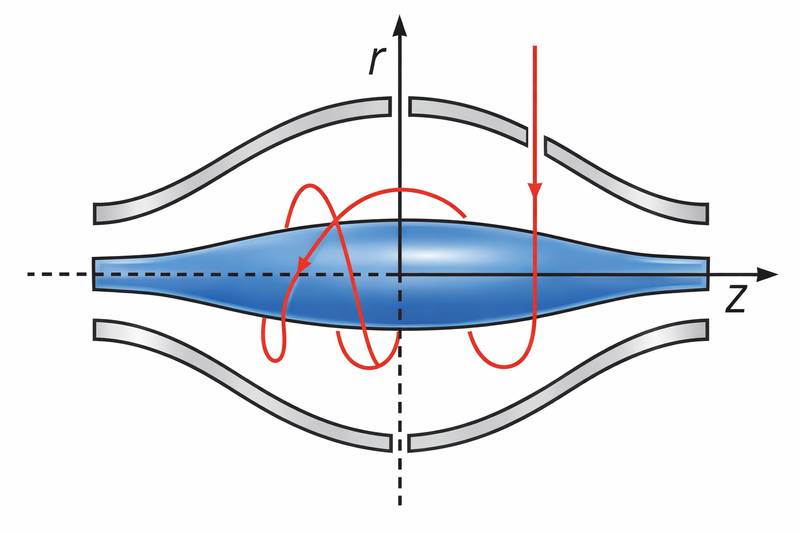
La géométrie particulière de ces électrodes est directement inspirée de la forme du champ électrostatique qu’elles génèrent. Les ions sont injectés tangentiellement dans ce champ, ce qui leur confère un mouvement orbital autour de l’électrode centrale.
Sous l’effet du champ électrostatique, les ions suivent une trajectoire hélicoïdale et oscillent le long de l’axe de l’Orbitrap.

La fréquence de cette oscillation axiale est indépendante de l’énergie cinétique initiale des ions et dépend uniquement de leur rapport m/z, ce qui constitue un avantage fondamental de cet analyseur.
Bien que l’Orbitrap soit un piège à ions, son principe de confinement diffère de celui des pièges radiofréquence classiques. Toutefois, la stabilité des trajectoires ioniques peut également être décrite par des équations différentielles de type Mathieu, traduisant le caractère oscillant du mouvement ionique dans le champ électrostatique.
Le champ électrostatique présent dans la cellule Orbitrap peut être décrit par l’équation suivante :
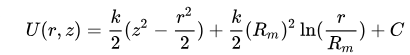
où r et z sont les coordonnées cylindriques, C une constante, k la courbure de champ Rm un rayon caractéristique. Le champ électrique produit donc deux forces qui permettent à l’ion de rester dans un mouvement circulaire continu dans l’interstice des deux électrodes.
L’ion injecté dans l’Orbitrap aura une trajectoire suivant l’équation.
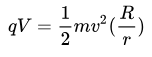
V est la différence de potentiel entre électrode central et électrode externe, R est le rayon de l’électrode externe, r : rayon électrode centrale.
Dans un analyseur Orbitrap, le mouvement des ions suit une trajectoire hélicoïdale autour de l’électrode centrale. Ce mouvement peut être décomposé en deux composantes indépendantes :
(i) un mouvement circulaire autour de l’électrode centrale, qui n’est pas exploité pour la mesure, et
(ii) un mouvement oscillatoire axial le long de l’axe z, dont la fréquence est utilisée pour déterminer le rapport m/z par transformation de Fourier.
Le mouvement axial des ions est entièrement indépendant des paramètres initiaux d’injection (énergie, position ou angle). La fréquence axiale dépend uniquement du rapport m/z de l’ion. L’oscillation des ions le long de l’axe z induit un courant image sur les électrodes externes de l’Orbitrap, courant qui est enregistré par le détecteur.
Le signal mesuré correspond à un signal transitoire dans le domaine temporel. Ce signal est ensuite transformé en un spectre de fréquences par transformation de Fourier, puis converti en un spectre de masse (m/z). À titre d’ordre de grandeur, un ion de m/z 524 possède une fréquence axiale d’environ 300 kHz ; cela signifie qu’il effectue environ trois allers-retours le long de l’électrode centrale par microseconde.
Injection des ions
Les ions sont injectés dans la cellule Orbitrap par paquets, ce qui nécessite l’utilisation d’un système de stockage d’ions. En effet, les ions sont produits de manière continue et doivent être accumulés avant d’être envoyés simultanément vers l’Orbitrap. L’injection des ions doit être très rapide (typiquement inférieure à 100–200 nanosecondes) : la durée d’introduction de chaque population d’ions de m/z donné doit être très courte par rapport à la demi-période de l’oscillation axiale correspondante.
En revanche, cette durée d’injection reste longue par rapport à la période des oscillations radiales. Cela entraîne un déphasage des ions de même m/z pouvant atteindre 50 à 100 oscillations radiales, conduisant à la formation d’un anneau d’ions autour de l’électrode centrale. Le paquet d’ions doit également être spatialement compact (de l’ordre de quelques millimètres) afin d’assurer la cohérence de phase des ions de même m/z le long de l’axe z.
Plusieurs méthodes ont été proposées pour injecter rapidement les ions dans l’Orbitrap, notamment l’utilisation de lentilles électrostatiques d’accélération [5] ou l’injection axiale à partir d’un piège à ions linéaire [6]. Toutefois, la méthode employée dans les instruments commerciaux repose sur l’utilisation d’un C-trap, qui permet une injection radiale des ions. Cette configuration minimise l’énergie cinétique initiale des ions selon la direction axiale (z), ce qui est essentiel pour garantir la stabilité et la cohérence du mouvement axial.
Après l’injection, un délai est appliqué afin de permettre aux ions de perdre leur cohérence radiale (typiquement 20 à 100 µs après l’injection). À ce stade, les ions de même m/z forment un anneau stable autour de l’électrode centrale. Par conséquent, l’effet des oscillations radiales s’annule et l’influence de la charge d’espace est fortement réduite, améliorant ainsi la qualité du signal mesuré (Shéma 2).

Le C-Trap
Inventé par Dr Alexander A. Makarov et de ses collaborateurs, Le C-trap est un piège à ions courbé en forme de C, équipé d’une porte électrostatique ainsi que d’une électrode de piégeage (trap electrode) placée à l’extrémité du dispositif (Figure 2). Les ions, produits de manière continue par la source d’ions, sont d’abord accumulés dans un piège à ions linéaire, puis transférés vers le C-trap. Le nombre d’ions stockés varie typiquement entre 20 000 et 2 000 000.
À l’intérieur du C-trap, les ions sont réfléchis par l’électrode de piégeage, à laquelle est appliqué un potentiel d’environ 12 à 15 V. Ils commencent alors à perdre leur énergie cinétique par collisions avec le gaz tampon présent dans le C-trap (pression typique ≈ 1 mTorr). Un potentiel est ensuite appliqué simultanément à la porte électrostatique et à l’électrode de piégeage afin de confiner les ions dans le C-trap.
Les ions sont ensuite éjectés de manière pulsée vers l’Orbitrap à travers un dispositif intermédiaire en forme de S, dont le rôle est d’accélérer et de compacter le paquet d’ions. Les ions pénètrent dans l’Orbitrap alors que la tension appliquée à l’électrode centrale a déjà été amorcée (environ 50 à 90 µs auparavant), mais n’a pas encore atteint sa valeur finale (environ 3 500 V).
Ainsi, les ions entrent dans l’Orbitrap pendant la phase de montée progressive du potentiel de l’électrode centrale. Cette technique, appelée « Electrodynamic Squeezing », permet de comprimer davantage le paquet d’ions et de réduire leur énergie de rotation. Ce contrôle est essentiel pour éviter les collisions des ions avec l’électrode centrale creuse et pour assurer une injection stable et cohérente dans l’Orbitrap.
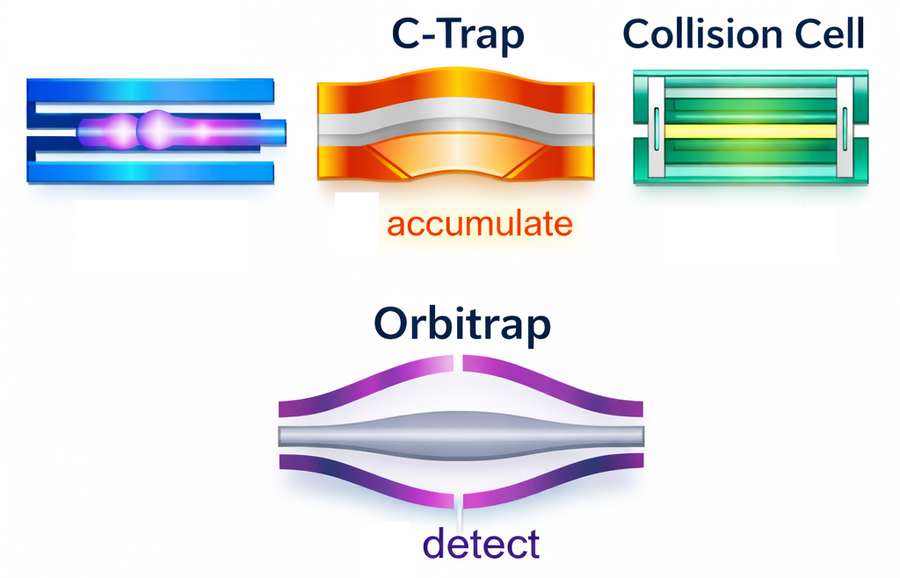
Spectrométrie de masse en tandem avec un Orbitrap
En principe, l’analyseur Orbitrap n’accepte les ions que par paquets, ce qui le rend a priori incompatible avec les sources d’ionisation continues telles que l’électrospray. Toutefois, les spectromètres de masse Orbitrap commerciaux sont le plus souvent des instruments hybrides, dans lesquels l’analyseur Orbitrap est couplé à d’autres analyseurs de masse, comme un piège ionique linéaire ou un quadrupôle. Dans ces configurations, les ions générés de manière continue sont d’abord accumulés, puis injectés dans la cellule Orbitrap sous forme de paquets. Cette architecture est également requise pour les sources d’ionisation pulsées, telles que le MALDI, car elle permet de corriger les distributions spatiales et énergétiques des ions générés dans la source avant leur injection dans l’Orbitrap. Par ailleurs, la fragmentation des ions est généralement réalisée dans les analyseurs associés à l’Orbitrap. Les ions fragments ainsi produits peuvent soit être détectés directement dans l’analyseur où la fragmentation a eu lieu, soit être transférés vers l’Orbitrap afin d’être analysés avec une haute résolution et une grande précision de masse (Schéma 3).
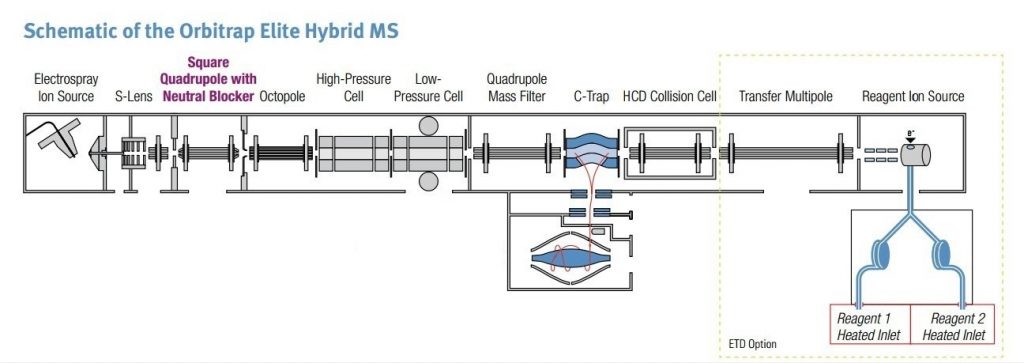
Bien que l’Orbitrap soit principalement conçu comme un analyseur de masse, il fonctionne également comme un piège à ions, permettant une certaine manipulation des ions à l’intérieur de sa cellule. La dynamique des ions dans l’Orbitrap est gouvernée par un diagramme de stabilité, issu de la solution de l’équation de Mathieu. Les ions présentant une faible valeur du paramètre qz peuvent ainsi être manipulés efficacement à l’aide d’une tension alternative.
En appliquant une tension radiofréquence correspondant à la fréquence axiale d’ions d’un rapport m/z donné, il est possible d’éjecter sélectivement ces ions. Un balayage en fréquence permet, quant à lui, d’éjecter l’ensemble des ions piégés. À l’inverse, en omettant la fréquence associée aux ions d’intérêt, ceux-ci peuvent être isolés, de manière analogue à ce qui est observé dans un piège ionique tridimensionnel. Les ions précurseurs ainsi isolés peuvent ensuite être excités afin d’induire leur fragmentation. Des travaux menés par Hu et al. ont démontré que les ions piégés dans l’Orbitrap peuvent être excités ou désexcités de façon résonante. En appliquant une radiofréquence déphasée de 180° par rapport au mouvement axial des ions d’intérêt, ceux-ci peuvent être désexcités, ce qui se traduit par la disparition du pic correspondant dans le spectre de masse. Lorsque la même radiofréquence est ensuite appliquée en phase, les ions sont ré-excités et le signal réapparaît.
Cette approche pourrait, en principe, être exploitée pour réaliser une fragmentation directe dans l’Orbitrap. En effet, la désexcitation des ions permet de réduire fortement leur mouvement axial, les amenant à une position proche de z = 0. Dans ces conditions, des méthodes de fragmentation classiques telles que la CID, l’IRMPD ou encore la fragmentation induite par le rayonnement du corps noir pourraient être appliquées. L’un des avantages majeurs de cette stratégie réside dans l’élimination du transfert des ions fragments vers un autre analyseur, tout en permettant de tirer parti d’un régime de collision à haute énergie, associé à une énergie cinétique des ions pouvant atteindre environ 1500 eV.
Cependant, cette technique présente des limitations importantes. Tout d’abord, le processus de désexcitation est relativement lent. Ensuite, les ions fragments générés possèdent des énergies cinétiques propres, libérées dans des directions variées, ce qui conduit à un élargissement du paquet d’ions. Par conséquent, les ions ne conservent plus un mouvement axial cohérent, rendant impossible leur désexcitation simultanée. Cette perte de cohérence compromet fortement la faisabilité d’une fragmentation efficace et contrôlée au sein de l’Orbitrap.
À ce jour, aucun spectromètre Orbitrap commercial ne propose la fragmentation directe des ions dans l’analyseur Orbitrap lui-même. Les expériences de spectrométrie de masse en tandem reposent donc toujours sur une fragmentation réalisée dans un analyseur externe, suivie de l’analyse des ions fragments dans l’Orbitrap.
Résolution et précision de masse et précision en masse
Les spectromètres de masse de type Orbitrap se distinguent par leur très haute résolution et leur excellente précision de masse. Bien que ces performances n’atteignent pas encore celles des spectromètres FT-ICR (Fourier Transform Ion Cyclotron Resonance) les plus avancés, elles sont néanmoins largement suffisantes pour la majorité des analyses courantes, notamment en protéomique et en métabolomique.
Une comparaison directe entre l’Orbitrap et le FT-ICR a été rapportée par Makarov et al. (2006). Pour des ions de m/z = 400, un Orbitrap classique atteint une résolution d’environ 60 000, tandis qu’un FT-ICR atteint typiquement 100 000 pour une durée d’enregistrement comparable. Toutefois, dans le FT-ICR, les ions peuvent rester cohérents plus longtemps au sein de la cellule ICR, ce qui permet d’augmenter la durée d’acquisition du signal. Cette prolongation conduit à une amélioration supplémentaire de la résolution, qui peut ainsi dépasser largement 100 000.
À l’inverse, dans l’Orbitrap, les ions perdent plus rapidement leur cohérence de phase. Une fois cette cohérence perdue, le courant image induit s’annule partiellement, ce qui limite l’efficacité d’un allongement du temps d’enregistrement. Par conséquent, contrairement au FT-ICR, l’augmentation de la durée d’acquisition dans l’Orbitrap n’entraîne pas nécessairement une amélioration de la résolution, celle-ci étant intrinsèquement limitée par la dynamique ionique dans le piège.
En revanche, l’Orbitrap présente un avantage notable aux rapports m/z élevés. En effet, sa résolution est inversement proportionnelle à la racine carrée de la masse, conformément à l’équation (4), alors que dans le FT-ICR la résolution est inversement proportionnelle à la masse elle-même. Il en résulte qu’au-delà de m/z ≈ 1100, et pour une durée d’enregistrement identique (et relativement courte), l’Orbitrap peut offrir une meilleure résolution que le FT-ICR. Ainsi, bien que le FT-ICR demeure la référence ultime en termes de résolution absolue, l’Orbitrap représente un excellent compromis entre résolution, précision de masse, vitesse de scan, robustesse instrumentale et accessibilité, en particulier pour les analyses à haut m/z et les applications de routine.
La résolution constitue l’un des paramètres clés conditionnant la précision de masse en spectrométrie de masse. Grâce à leur pouvoir résolutif élevé, les spectromètres de masse de type Orbitrap peuvent atteindre une précision de masse inférieure à 1 ppm lorsqu’une calibration interne est appliquée. En revanche, lors d’une calibration externe, la précision de masse est généralement moins élevée, typiquement inférieure à 3 ppm. Cette dégradation est principalement due aux variations instrumentales, notamment les fluctuations de température, susceptibles d’affecter la stabilité du champ électrostatique et, par conséquent, la mesure de la fréquence des ions.
Une stratégie efficace pour améliorer la précision de masse, tout en conservant une calibration externe, consiste à utiliser une masse verrou (“lock mass”). Le principe repose sur l’introduction, dans le spectre, d’un ion de rapport m/z connu avec une grande précision, analysé simultanément avec les ions d’intérêt. Cet ion de référence permet de corriger en continu les dérives de masse au cours de l’acquisition. En protéomique, l’ion de m/z 445,120025 est couramment employé comme lock mass. Cet ion provient de composés siloxanes, omniprésents dans l’atmosphère et facilement ionisables, ce qui garantit sa présence stable dans les spectres sans ajout intentionnel d’un étalon externe. L’utilisation d’un lock mass permet ainsi une amélioration significative de la précision de masse, sans compromettre la vitesse d’analyse ni la robustesse expérimentale. Osen et al. ont notamment rapporté une amélioration de la précision de masse, passant de 3,7 ppm à 0,9 ppm grâce à l’emploi d’un lock mass.
