Ionisation électronique : explication correcte et clarifiée
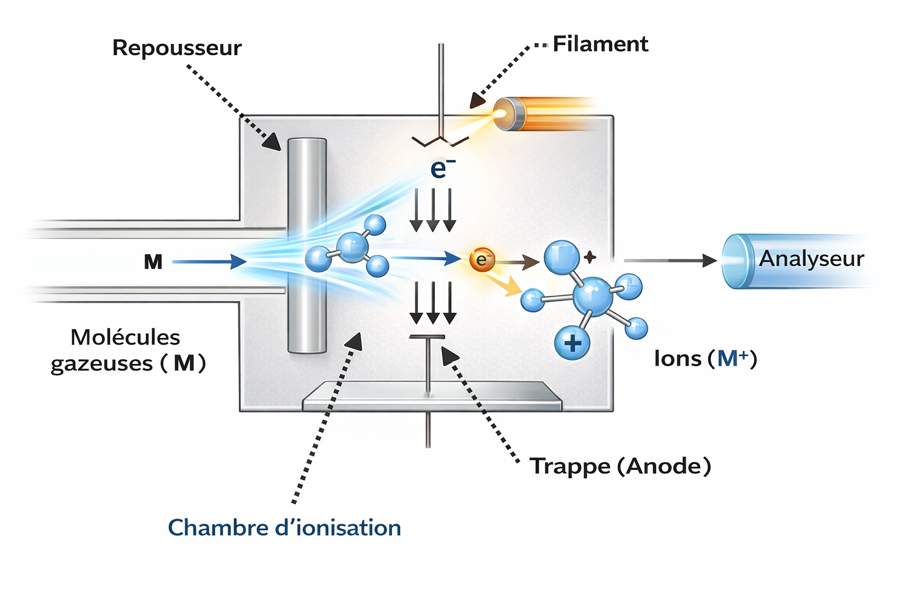
L’ionisation électronique (IE), ou electron ionization, est la plus ancienne source d’ionisation utilisée en spectrométrie de masse. Le terme impact électronique est parfois employé à tort : il suggère qu’un électron « percute » physiquement la molécule, ce qui n’est pas vrai.
- Pourquoi il n’y a pas de “collision physique” entre un électron et une molécule ?
Un atome est presque entièrement vide. Si le noyau avait la taille d’un ballon de football, l’atome entier aurait la taille d’un terrain de football, et l’électron serait une petite bille tournant très loin autour. Ainsi, atomiquement parlant, les électrons traversent un “réseau creux” et ne heurtent presque jamais réellement un autre objet.
Donc, lorsque l’on envoie un faisceau d’électrons sur des molécules, le contact mécanique direct est pratiquement impossible.
- Alors comment se fait l’ionisation ? Grâce à l’onde de l’électron
Un électron qui voyage avec certaine vitesse est accompagné par une onde dont la longueur est:
λ = h/mv (h, constante de Plank, m la masse d’électron et v la vitesse)
Cette onde associée à l’approche de la molécule devient complexe et en interaction avec d’autre vibration des liaisons de la molécule. L’énergie transmise peut arracher un électron de la molécule, créant :
- Un ion moléculaire positif M⁺·,
- Éventuellement plusieurs ions fragments.
- Pourquoi observe-t-on rarement des ions multichargés en IE ?
La probabilité qu’une molécule rencontre un électron est faible, et celle qu’un ion déjà formé rencontre un second électron est encore plus faible.
C’est pourquoi les ions multichargés sont très rare en ionisation électronique.
On peut observer la perte de plusieurs électrons dans des conditions particulières (dans certains analyseurs de masse, ou lorsqu’un ion déjà formé est ré-ionisé), mais ce n’est pas le cas standard.
- Pourquoi utilise-t-on 70 eV ?
On lit souvent que 70 eV provoque plus de fragmentation car l’excédent d’énergie (au-delà des ~10 eV nécessaires pour ioniser) « casse » les ions.
Ceci est incorrect.
✔ À 70 eV, on obtient :
- Le meilleur rendement d’ionisation (figure 2)
(les électrons ont une longueur d’onde qui maximise la probabilité d’interaction), - Des spectres très reproductibles, ce qui permet la comparaison entre bases de données.
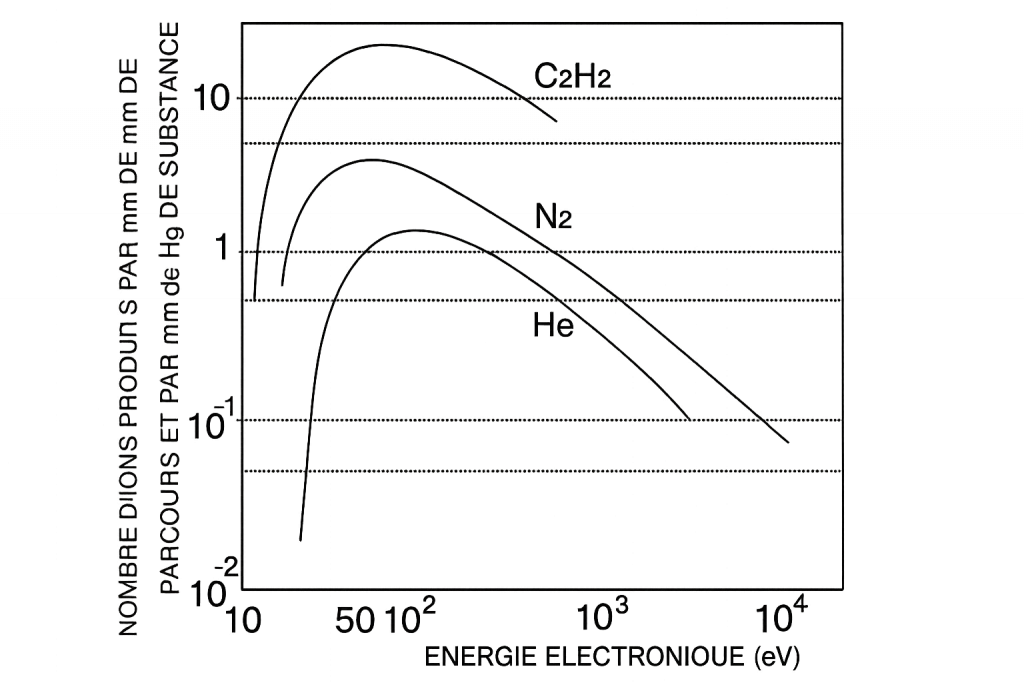
✘ Réduire l’énergie à 20–40 eV :
- Ne rend pas l’ionisation significativement plus douce,
- Ne préserve pas forcément l’ion moléculaire,
- Diminue fortement la sensibilité (moins d’ions formés),
- Ne change presque pas l’intensité relative des ions produits.
La fragmentation provient surtout du réarrangement interne de l’ion après qu’un électron lui a été arraché, un phénomène comparable au retour en place d’un élastique brusquement lâché :
ce n’est pas la vitesse du tir qui blesse, mais le retour.
Avantages et inconvénients de l’ionisation électronique
Avantages
- Source d’ionisation “dure” : production de spectres riches en fragments
L’ionisation électronique fournit énormément d’informations structurales grâce aux nombreux fragments générés.
Ces fragments suivent souvent des chemins de fragmentation reproductibles et interprétables.
- Large compatibilité avec les petites molécules volatiles
La source IE peut ioniser la plupart des molécules capables de passer en phase gazeuse, ce qui inclut :
- les petites molécules organiques,
- de nombreux composés volatils ou semi-volatils,
- les analytes pouvant être vaporisés sans dégradation.
- Immense base de données de référence
L’IE est la technique historique de la spectrométrie de masse.
Il existe donc :
- des millions de spectres dans les bibliothèques (NIST, Wiley…),
- des spectres extrêmement reproductibles d’un instrument à l’autre.
Cela permet l’identification rapide d’inconnus par comparaison.
- Spectres très reproductibles
À 70 eV, l’énergie est standardisée : un spectre obtenu aujourd’hui peut être directement comparé à un spectre acquis il y a 40 ans.
Inconvénients
- Nécessité d’une phase gazeuse
L’IE impose que l’analyte soit vaporisé.
Cela limite fortement la technique aux molécules :
- peu polaires,
- de masse modérée,
- thermiquement stables.
Cela exclut ou complique l’analyse :
- des biomolécules (protéines, peptides, lipides complexes),
- des polymères,
- des molécules thermolabiles (dégradation à la chaleur).
Dans certains cas, il est nécessaire de dériver chimiquement la molécule pour la rendre volatile (ex. dérivés triméthylsilylés).
- Ionisation “dure” → fragmentation importante
L’IE fragmente fortement les ions formés.
Conséquences :
- ion moléculaire souvent faible ou absent, ce qui rend difficile :
- la détermination de la masse molaire exacte,
- certaines études structurales,
- la quantification directe.
- Peu adaptée aux molécules de grande masse
Les grosses molécules ne :
- vaporisent pas,
- se dégradent avant ionisation.
Ainsi, l’IE n’est pas utilisée pour les biomolécules : on préfère ESI ou MALDI.
